ボルツマン定数を分かりやすく解説!気体の運動エネルギーとの関係も

ボルツマン定数は、気体定数をアボガドロ定数で割った値です。
つまり、分子1個あたりの気体定数ということになります。
ボルツマン定数という名前の通り、オーストリアの物理学者ルートヴィヒ・ボルツマンにちなんで名づけられた定数です。
ルートヴィヒ・ボルツマンは統計力学の分野で大きな貢献をしました。
この記事では、ボルツマン定数についてまとめます。
【PR】勉強を効率的に継続して、志望校に合格したい方必見!

↓無料ダウンロードはこちら↓
ボルツマン定数とは
ボルツマン定数は専門的には、統計力学で登場する物理定数です。
語源になったルートヴィヒ・ボルツマンは、オーストリアの物理学者で、統計力学の分野で非常に大きな功績を残しました。
におけるkがボルツマン定数です。
ボルツマンの公式は高校では扱いませんから、忘れてしまって構いません。
ボルツマン定数は、高校物理においては、熱と物質の状態の分野において登場します。
気体の状態方程式
に出現する気体定数Rを、アボガドロ定数 N0 で割った値が、ボルツマン定数です。
ボルツマン定数は通常kで表されることが多いですが、ボルツマンの名前にちなんでkBと表されることもあります。
ボルツマン定数は、

ですから、
という値になります。
しっかり理解しておきましょう。
ボルツマン定数で必要な「気体の状態方程式」と諸法則
高校で扱うボルツマン定数は、気体定数をアボガドロ定数で割ったものです。
つまり、「気体1分子あたりの気体定数」であると言えます。
では、気体定数やアボガドロ定数とはどのようなものでしょうか。
圧力とは、単位面積当たりに加わる力のことで、
という式で定義されます。分かりやすく説明すると、気体をピストンのついている容器に入れると、気体は容器の中を熱運動してピストンを押し返そうとしますね。これが気体の圧力です。代表的な単位は[atm](アトム), [mmHg](ミリメートル水銀柱)、[Pa](パスカル)=[N/m2]です。
ところで、身の回りにはあるさまざまな物質は莫大な数の分子によって構成されています。
ですから、そのままの数で表すと、数字が大きくなり扱いにくくなるので、
6.02×1023
をひとまとめにして数えることにしています。
原子・分子・イオンなどの粒子 6.02×1023 個の集まりを1molといいます。
この個数をアボガドロ定数といい、[/mol]の単位で表します。
理想気体の圧力などに関する諸法則は以下のようなものがあります。
ボイルの法則 :一定温度において、一定量の気体の体積Vは、圧力Pに反比例する
シャルルの法則 :一定圧力において、一定量の気体の体積Vは、絶対温度Tに比例する
ボイル・シャルルの法則 :一定量の気体の体積Vは、圧力Pに反比例し、絶対温度Tに 比例する
アボガドロの法則 :気体の種類によらず、同一圧力、同一温度、同一体積の気体 に含まれる分子の数は同じ
=一定温度、一定圧力において気体の体積Vは物質量nに比例
これらの気体の諸法則をすべて合わせたものが、以下の気体の状態方程式になります。
とても大切な方程式なので、必ず覚えましょう。
また、標準状態(0℃、1atm)の理想気体1mol の体積は22.4l(22.4×10-2m3/mol)であることがわかっています。
気体定数Rの値を求めるには、この数字を気体の状態方程式に代入することで求められます。
そして、[N・m]=[J]ですから、気体定数Rの値は以下のようになります。
ボルツマン定数と気体分子の運動エネルギー
気体が容器に入った状態では、非常に多くの分子が不規則に熱運動し、容器を押します。
気体分子1個が及ぼす力は小さいですが、多くの分子が衝突するため、全体としては大きな力になり、あらゆる面で一様な力であるとみなすことができます。
気体分子の運動と気体の圧力について考えてみましょう。
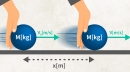
1辺の長さL、体積V(=L3)の立方体の容器に質量m、分子の数N個であるような理想気体を入れます。
(このとき、分子同士の衝突は無視して、分子と容器は完全弾性衝突するとします)
1つの分子の速度を、そのx, y, z 成分をそれぞれ、vx,vy,vzとします。
ある気体分子がx軸正方向にある壁面Sに衝突した場合、vy,vzは変化せず、vxが完全弾性衝突によって-vxに変化します。
つまり、運動量を考えると-2mvxだけ変化し、壁面Sはこの分子に2mvxだけ力積をうけます。
この気体分子は、他の分子との衝突を無視しているので、次に壁面Sに衝突するまでの時間はであり、1秒間に
回だけ衝突します。
t秒間なら回ですから、壁面Sはこの分子からt秒間で
の力を受けることになります。
これを平均化して、常に一定の力を受けると考えると、その力積は
ですから、
となります。
壁面SがN個の分子から受ける力を考えると、すべての分子は不規則に運動していますからとみなすことができます。
N個の分子から壁面Sが受ける力Fは
です。
なので、壁面Sが受ける圧力pは以下の式のようになります。
この式を、気体の状態方程式を使って変形します。
アボガドロ定数をN0とすると、気体の分子数N=nN0なので、
となります。この式に登場する
は、気体定数をアボガドロ定数で割った値なので、ボルツマン定数です。
から理想気体では、平均運動エネルギーは絶対温度Tのみに比例し、気体の種類によらないことがわかります。
このときの比例定数に関係するのがボルツマン定数です。
最初に申し上げた通り、ボルツマン定数の単位は[J/K]です。ここから、ボルツマン定数とは、気体の運動エネルギーが温度によってどのように変化するかを表す値である、ということが分かります。
ボルツマン定数の例題
問. 気体分子の運動エネルギーと絶対温度の関係式
から、絶対零度より低い温度が存在しないことを考察せよ。ただし、kBはボルツマン定数である。
(*解答・解説は下にスクロール)
解答・解説
難関大学の問題であれば、この問の前に上記の式を求めるような問題が、ヒント付きで与えられるでしょう。
その場合は、「ボルツマン定数と気体分子の運動エネルギー」でご説明した通りの手順で、上記の式を導きましょう。
問題で与えられた式の左辺は、気体分子全体の平均的な運動エネルギーを表します。
そして、右辺は定数に絶対温度をかけた値になっています。
つまり、気体分子の運動は、その気体の絶対温度によって決まることになります(熱運動)。
もし、分子の運動が止まると、左辺は0になりますから、右辺も0になります。
右辺が0になるということは、温度が0になるということです。
左辺をみると、負の値をとることはありませんから、このときの温度が最も低い温度であることになります。
これを、分子の運動が静止するときの温度を絶対零度といい、これよりも低い温度は存在しません。
ボルツマン定数のまとめ
最後までご覧くださり、ありがとうございました。
この記事では、ボルツマン定数と気体の運動エネルギーについてまとめました。
ご参考になれば幸いです。