熱力学第一法則がイラストですぐわかる!練習問題付き

熱力学第一法則を、スマホでも見やすいイラストで解説していきます。物理が苦手な人でも、熱力学第一法則を理解できる内容です。
熱力学第一法則では、断熱変化(断熱圧縮・断熱膨張など)と一緒に解説されることが多いです。本記事でも、それらを用いて丁寧に熱力学第一法則を解説していきます。
また、最後には熱力学第一法則が理解できたかを試すのに最適な練習問題もご用意しました!
本記事を読み終える頃には、熱力学第一法則をマスターできているでしょう。ぜひ最後までお読みください。
【PR】勉強を効率的に継続して、志望校に合格したい方必見!

↓無料ダウンロードはこちら↓
①熱力学第一法則:公式
まずは熱力学第一法則の公式を紹介します。物理が苦手な人でも熱力学第一法則が理解できるように解説したので安心して読んでください!
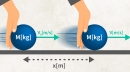
下のイラストのように、気体を容器に入れて閉じ込めます。
そして、その容器に外から熱量Q[J]を与えたり、仕事W[J]を加えます。
すると、気体の内部エネルギーはそのぶんだけ増加します。内部エネルギーの増加量をΔU[J]とすると、ΔU=Q+Wの関係が成り立ちます。これを熱力学第一法則と呼んでいます。
気体を圧縮するとき仕事Wは正、膨張させるとき仕事Wは負です。仕事について詳しく学習したい人は、仕事について解説した記事をお読みください。
※内部エネルギーがわからない人のための説明は以下にあります。
[熱力学第一法則の公式]
ΔU = Q + W
(Q:外から与えた熱量、W:外から与えた仕事)
ここからは、内部エネルギーがわからない人向けの説明です。内部エネルギーが理解できている人は、②断熱変化における熱力学第一法則へお進みください!
内部エネルギーとは?
物体が運動したり、高い位置にあったりするとき、その物体は力学的エネルギー(運動エネルギーと位置エネルギーを合計したエネルギーのこと)を持ちます。
同様に、物体を構成している原子や分子も熱運動の運動エネルギーや分子間引力による位置エネルギーを持ちます。このような、物体内部で原子や分子が持っているエネルギーのことを内部エネルギーと呼んでいます。
内部エネルギーは個々の原子や分子の運動エネルギーと位置エネルギーの総和です。
[補足:内部エネルギーの増加]
先ほどのイラストのように、物体に外部から熱を与えたり、仕事を加えると、原子や分子の運動が盛んになります。その結果、内部エネルギーが増加します。このため、物体の温度が上がるのです。
②断熱変化における熱力学第一法則
熱力学第一法則では、断熱変化の事例がよく取り上げられます。大事な学習内容なので、本記事でも丁寧に解説していきます。
気体を、熱が伝わらない容器に入れ、外部との間で熱の出入りができないようにします。その状態で圧力・体積・温度を変化させることを断熱変化といいます。
断熱圧縮
上記の状態の容器(外部との間で熱の出入りができない)に綿を入れて、気体を圧縮します。(下のイラスト参照)
このとき、綿は発火します。なぜでしょうか?
このイラストの場合、熱力学第一法則より、熱量Q=0で、仕事W>0ですね。
よって、ΔU=0+W=W>0 です。気体の内部エネルギーΔUは、外部がした仕事Wのぶんだけ上昇しますね。よって、空気の温度が上がり、綿が発火します。
断熱膨張
次は断熱膨張を考えてみましょう。気体を断熱的に膨張させると、気体が外部に正の仕事します。(上記の断熱圧縮と逆です。)よって、外力は気体に負の仕事W’をすることになります。したがって、W’は負であることに注意してください。
よって、熱力学第一法則より、ΔU=0+W'<0です。内部エネルギーは減少するので、気体の温度は下がりますね。
[まとめ]
断熱圧縮・・・温度が上がる
ΔU=W>0
断熱膨張・・・温度が下がる
ΔU=W<0
[断熱膨張の豆知識]
断熱膨張が利用されている例としては、消火器(二酸化炭素消火器)が挙げられます。消火器では、圧縮されて液化した二酸化炭素がボンベに入っています。これが大気中に放出されると、断熱膨張により急激に温度が下がります。この冷却し不燃の二酸化炭素ガスが火を包んで消火する仕組みになっているのです。
③熱力学第一法則:練習問題
最後に、今回学習した熱力学第一法則の理解を試すのに最適な練習問題を用意しました。ぜひ解いて熱力学第一法則をマスターしましょう!詳しい解答&解説付きです。
[熱力学第一法則の練習問題]
下の図のように、ピストンが大気中に置かれている。容器には気体が入っており、電気抵抗R[Ω]のヒーターで暖めることができる。
(1)ヒーターに電圧V[V]をかけた時、時間t[s]の間に発生する熱量Q[J]を求めよ。
(2)ヒーターで8.8[J]の熱量を気体に与えたところ、気体はゆっくりと膨張し、外部に2.5[J]の仕事をした。気体の内部エネルギーの増加分を求めよ。
[解答&解説]
(1)熱量Q[J]の求め方は覚えていますか?忘れた人は、熱量について解説した記事を読んでもう一度見直しましょう。
Q=VItという公式でしたね。しかし、このままでは、Iがわかりません。。ここで、オームの法則を使いましょう!
オームの法則より、V=RIでした。よって、I=V/Rです。これをQ=VItに代入すれば良いですね。
従って、求める熱量Qは、
Q
=V・V/R・t
=V2t/R・・・(答)
(2)熱力学第一法則を利用しましょう。内部エネルギーの増加量ΔUは、気体が外部からされた仕事W=-2.5[J]と、外部から気体に加えた熱Q=8.8[J]の和ですね。
よって、
ΔU
=Q + W
=8.8 – 2.5
=6.3[J]・・・(答)
熱力学第一法則のまとめ
いかがでしたか?熱力学第一法則についての説明は以上になります。圧縮するときはWが正に、膨張するときはWが負になるということはしっかり覚えておきましょう。